Wie neemt contact met ons op?
Een temperatuuroverschrijding wordt gedefinieerd als het bewaren of blootstellen van een product van Roche ongeacht hoe lang aan temperaturen die buiten het bereik van de temperatuur voor bewaren liggen die in de productinformatie vermeld staan.
Bent u een…
Details over de temperatuuroverschrijding
Definitie:
Een temperatuuroverschrijding wordt gedefinieerd als het bewaren of blootstellen van een product van Roche ongeacht hoe lang aan temperaturen die buiten het bereik van de temperatuur voor bewaren liggen die in de productinformatie vermeld staan.
Geef details over de temperatuuroverschrijding, maar geef geen persoonsgegevens (waaronder gevoelige persoonsgegevens). Voor een juiste beoordeling is het belangrijk dat de gegevens over tijd en temperatuur die u heeft verstrekt, allebei volledig en nauwkeurig zijn. Op de volgende pagina kunt u de betreffende producten toevoegen.
Specificeer de gemeten temperatuuroverschrijding(en) (één waarde is verplicht)
Duur onder ondergrens
Duur boven bovengrens
Hoe vaak is de temperatuur onder de 0,5°C gedaald en weer gestegen naar 0,5°C?
Eventuele andere bijzonderheden?
Voeg het logboek van uw koelkast toe (optioneel)
Productinformatie
Extra producten? ({{form.products[index].index}})
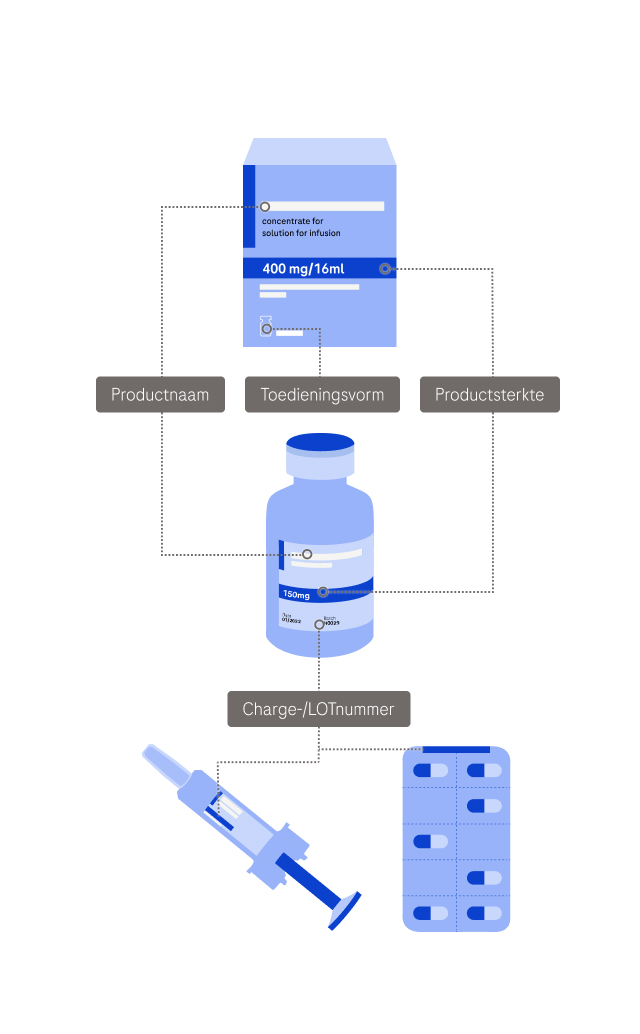
Geef informatie over de betreffende producten. U kunt meerdere producten toevoegen met de knop ‘Voeg product toe’ onderaan deze pagina.
Betreffende Columvi (glofitamab), Enspryng (satralizumab), Itovebi (inavolisib), Lunsumio (mosunetuzumab), Piasky (crovalimab), Ronapreve (casirivimab & imdevimab), Rozlytrek (entrectinib), Vabysmo (faricimab):
▼ Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg worden verzocht alle mogelijke bijwerkingen to rapporteren.
Als er zich een zwangerschap voordoet tijdens het gebruik van Herceptin / PERJETA/ Kadcyla/Phesgo of binnen de 7 maanden na de laatste dosis Herceptin / Kadcyla//Phesgo of binnen de 6 maanden na de laatste dosis PERJETA, meld die dan onmiddellijk aan de Drug Safety Line van Roche op + 32 2 525 82 99.
Er zal bijkomende informatie gevraagd worden tijdens de zwangerschap die is opgetreden terwijl Herceptin / PERJETA / Kadcyla/Phesgo werd ingenomen en tijdens het eerste levensjaar van de zuigeling. Hierdoor zal Roche een beter inzicht krijgen in de veiligheid van Herceptin / PERJETA / Kadcyla/Phesgo en zal het bedrijf de gezondheidsinstanties, zorgverleners en patiënten de juiste informatie kunnen verschaffen.
Welke producten zijn getroffen door de gemelde overschrijding?
Heeft u een patiënt die wacht op het product?
Is het product betrokken geweest bij een eerdere temperatuuroverschrijding terwijl het in uw bezit was?
Is het product gereconstitueerd/verdund?
Is the product at its final storage location before being administered /dispensed /supplied to the patient?
Has the product been administered to the patient?
Producten die zijn getroffen door de gemelde overschrijding
Contactgegevens
Vul het formulier verder in door uw contactgegevens toe te voegen
Ik ga ermee akkoord dat mijn gegevens worden verwerkt om mijn vraag te kunnen beantwoorden in overeenstemming met het Roche Privacybeleid & Privacyverklaring voor geneesmiddelenbewaking.
Door het bovenstaande vakje aan te vinken gaat u ermee akkoord dat uw gegevens worden verwerkt om uw vraag te kunnen beantwoorden in overeenstemming met de Kennisgeving bescherming persoonsgegevens voor geneesmiddelenbewaking en medische informatie van Roche. Als u niet instemt met de gegevensverwerking kunnen we uw bericht niet beantwoorden en vragen we u op een andere manier contact met ons op te nemen.
F. Hoffmann-La Roche Ltd (‘Roche’) bewaart uw persoonsgegevens om te reageren op uw vraag, om dergelijke verzoeken op te volgen, om de informatie ter referentie in de database met medische informatie van Roche te bewaren en om te voldoen aan onze wettelijke en regelgevende verplichtingen met betrekking tot vastlegging en melding. De bewaartermijn van gegevens is in overeenstemming met de relevante wet- en regelgeving.
Door persoonsgegevens van een andere betrokkene in het formulier op te nemen, rechtvaardigt u het verwerken van dergelijke persoonsgegevens.
In het Privacybeleid van Roche staat meer gedetailleerde informatie over uw rechten en hoe Roche persoonsgegevens verwerkt.
Uw melding
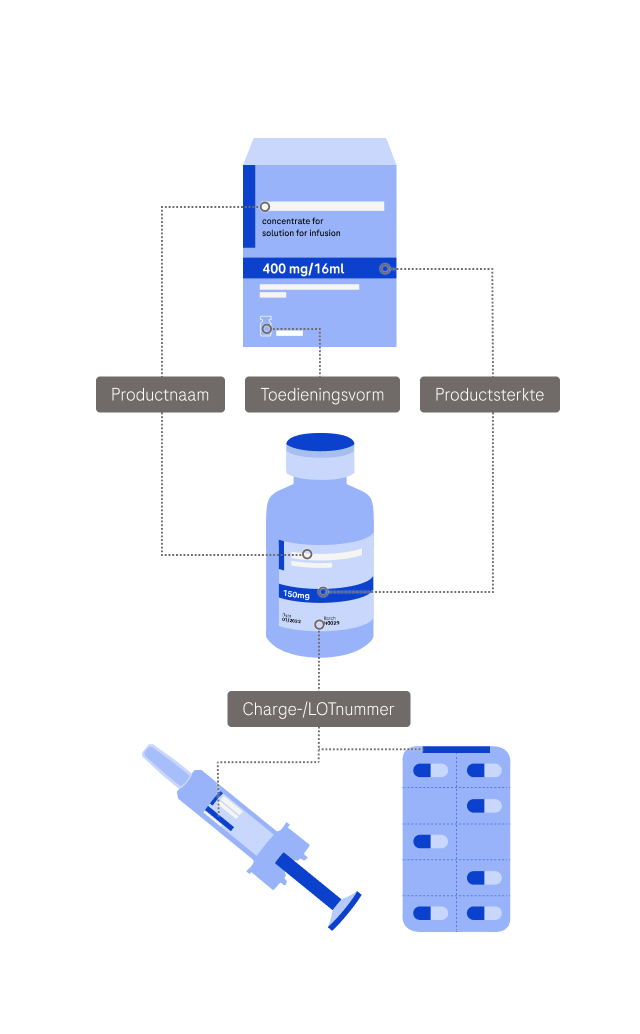
Over welk product van Roche gaat de melding? Geef zoveel mogelijk informatie over het product en het incident, maar geef geen persoonsgegevens (waaronder gevoelige persoonsgegevens). Deze informatie wordt doorgestuurd naar de lokale vestiging van Roche die misschien contact met u opneemt voor meer informatie. U krijgt een bericht zodra uw casus is beoordeeld. Zorg ervoor dat het product op de juiste manier wordt bewaard terwijl u wacht op onze reactie.
Betreffende Columvi (glofitamab), Enspryng (satralizumab), Itovebi (inavolisib), Lunsumio (mosunetuzumab), Piasky (crovalimab), Ronapreve (casirivimab & imdevimab), Rozlytrek (entrectinib), Vabysmo (faricimab):
▼ Dit geneesmiddel is onderworpen aan aanvullende monitoring. Daardoor kan snel nieuwe veiligheidsinformatie worden vastgesteld. Beroepsbeoefenaren in de gezondheidszorg worden verzocht alle mogelijke bijwerkingen to rapporteren.
Als er zich een zwangerschap voordoet tijdens het gebruik van Herceptin / PERJETA/ Kadcyla/Phesgo of binnen de 7 maanden na de laatste dosis Herceptin / Kadcyla//Phesgo of binnen de 6 maanden na de laatste dosis PERJETA, meld die dan onmiddellijk aan de Drug Safety Line van Roche op + 32 2 525 82 99.
Er zal bijkomende informatie gevraagd worden tijdens de zwangerschap die is opgetreden terwijl Herceptin / PERJETA / Kadcyla/Phesgo werd ingenomen en tijdens het eerste levensjaar van de zuigeling. Hierdoor zal Roche een beter inzicht krijgen in de veiligheid van Herceptin / PERJETA / Kadcyla/Phesgo en zal het bedrijf de gezondheidsinstanties, zorgverleners en patiënten de juiste informatie kunnen verschaffen.
Productnaam
Extra productdetails
Wat is er met het product gebeurd?
Contactgegevens
Vul het formulier verder in door uw contactgegevens toe te voegen
Ik ga ermee akkoord dat mijn gegevens worden verwerkt om mijn vraag te kunnen beantwoorden in overeenstemming met het Roche Privacybeleid & Privacyverklaring voor geneesmiddelenbewaking.
Door het bovenstaande vakje aan te vinken gaat u ermee akkoord dat uw gegevens worden verwerkt om uw vraag te kunnen beantwoorden in overeenstemming met de Kennisgeving bescherming persoonsgegevens voor geneesmiddelenbewaking en medische informatie van Roche. Als u niet instemt met de gegevensverwerking kunnen we uw bericht niet beantwoorden en vragen we u op een andere manier contact met ons op te nemen.
F. Hoffmann-La Roche Ltd (‘Roche’) bewaart uw persoonsgegevens om te reageren op uw vraag, om dergelijke verzoeken op te volgen, om de informatie ter referentie in de database met medische informatie van Roche te bewaren en om te voldoen aan onze wettelijke en regelgevende verplichtingen met betrekking tot vastlegging en melding. De bewaartermijn van gegevens is in overeenstemming met de relevante wet- en regelgeving.
Door persoonsgegevens van een andere betrokkene in het formulier op te nemen, rechtvaardigt u het verwerken van dergelijke persoonsgegevens.
In het Privacybeleid van Roche staat meer gedetailleerde informatie over uw rechten en hoe Roche persoonsgegevens verwerkt.