Évaluation d'un produit Roche qui a été stocké en dehors de la plage de température recommandée
Une variation ou une rupture de température est définie comme le stockage ou l'exposition d'un produit Roche en dehors des températures de stockage indiquées pendant une durée indéterminée.
Qui nous contacte…
Détails sur la variation de température
Définition:
Une variation ou une rupture de température est définie comme le stockage ou l'exposition d'un produit Roche en dehors des températures de stockage indiquées pendant une durée quelconque.
Veuillez fournir les détails sur la variation de température, mais ne fournissez aucune donnée personnelle (y compris les données personnelles sensibles). Pour permettre une évaluation précise, il est important que les données de temps et de température que vous avez fournies soient à la fois complètes et exactes. Vous pourrez ajouter les produits concernés sur la page suivante.
Précisez la (les) variation(s) de température enregistrée(s) (une valeur est obligatoire)
Durée inférieure à la limite inférieure
Durée supérieure à la limite supérieure
Combien de fois la température est-elle descendue en dessous de 0,5°C et est-elle remontée à 0,5°C ?
D'autres détails ?
Joindre la fiche d'enregistrement de votre réfrigérateur (facultatif)
Information produit
D'autres produits? ({{form.products[index].index}})
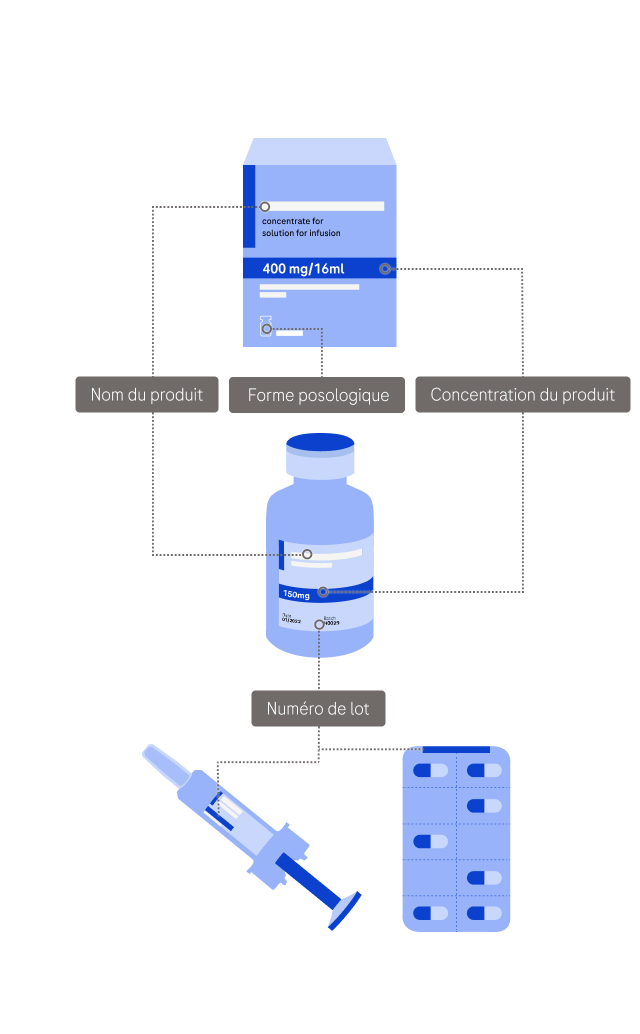
Veuillez fournir des informations sur les produits concernés. Vous pouvez ajouter plusieurs produits en utilisant le bouton "Ajouter un produit" au bas de cette page.
Concernant Columvi (glofitamab), Enspryng (satralizumab), Itovebi (inavolisib), Lunsumio (mosunetuzumab), Piasky (crovalimab), Ronapreve (casirivimab & imdevimab), Rozlytrek (entrectinib), Vabysmo (faricimab):
▼ Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Si une grossesse survient durant l'utilisation de Herceptin / PERJETA/ Kadcyla /Phesgo ou dans les 7 mois qui suivent la dernière dose de Herceptin/Kadcyla/Phesgo ou dans les 6 mois qui suivent la dernière dose de PERJETA, veuillez immédiatement signaler la grossesse à la Drug Safety Line de Roche au +32 2 525 82 99.
Des informations supplémentaires seront demandées pendant la grossesse exposée au Herceptin / PERJETA / Kadcyla/ Phesgo et durant la première année de vie du nourisson. Cela permettra à Roche de mieux connaître la sécurité du Herceptin / PERJETA/ Kadcyla / Phesgo et de fournir des informations appropriées aux autorités sanitaires, aux prestataires de soins de santé et aux patients.
Quels produits ont été touchés lors de la variation signalée ?
Avez-vous un patient qui attend le produit ?
Le produit a-t-il été impliqué dans une précédente variation de température alors qu'il était en votre possession ?
Le produit a été reconstitué / dilué ?
Is the product at its final storage location before being administered /dispensed /supplied to the patient?
Has the product been administered to the patient?
Produits concernés par la variation signalée
Coordonnées
Veuillez fournir des informations sur les produits concernés. Vous pouvez ajouter plusieurs produits en utilisant le bouton "Ajouter un produit" au bas de cette page.
Je consens à ce que mes données soient traitées dans le but de répondre à ma demande et conformément à la Politique de Confidentialité de Roche & Notice de Confidentialité pour la Pharmacovigilance.
Vous consentez, en cochant la case ci-dessus, à ce que vos données soient traitées dans le but de répondre à votre demande et conformément à l'avis de Roche sur la confidentialité en matière de pharmacovigilance, d'informations médicales et de plaintes concernant les produits. Si vous ne consentez pas au traitement de vos données, nous ne pourrons pas répondre à votre message et vous prions de bien vouloir utiliser d'autres canaux pour nous contacter.
F. Hoffmann-La Roche Ltd ("Roche") conservera un enregistrement des données personnelles que vous fournissez dans le but de répondre à votre demande, de donner suite à de telles demandes, de conserver les informations dans la base de données d'informations médicales de Roche pour référence et de se conformer à nos obligations légales et réglementaires d'enregistrement et de rapport. La durée de conservation des données est conforme aux lois et règlements respectifs.
En incluant les données personnelles d'une autre personne dans le formulaire, vous déclarez la légalité du traitement de ces données personnelles.
La politique de confidentialité de Roche fournit des informations détaillées sur vos droits et sur la manière dont Roche traite les données personnelles.
Votre rapport
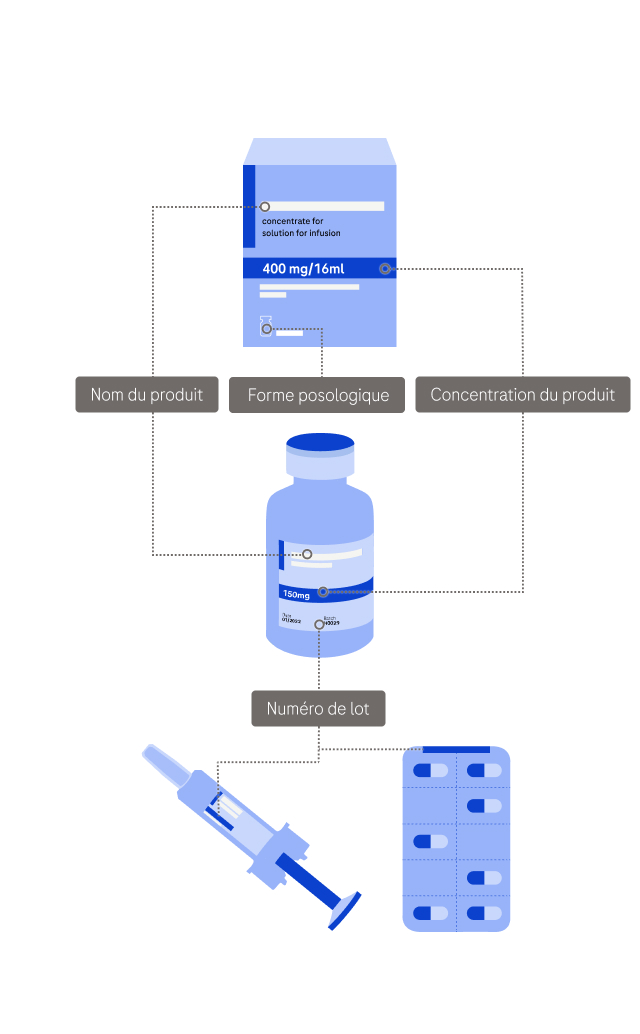
Quel produit Roche a été touché ? Veuillez fournir autant d'informations que possible sur le produit et l'événement, mais ne fournissez aucune donnée personnelle (y compris les données personnelles sensibles). Ces informations seront envoyées au bureau local de Roche qui pourra vous contacter pour de plus amples informations. Vous recevrez une notification une fois que votre cas aura été évalué. Veuillez vous assurer que le produit est correctement stocké en attendant de recevoir une réponse de notre part.
Concernant Columvi (glofitamab), Enspryng (satralizumab), Itovebi (inavolisib), Lunsumio (mosunetuzumab), Piasky (crovalimab), Ronapreve (casirivimab & imdevimab), Rozlytrek (entrectinib), Vabysmo (faricimab):
▼ Ce médicament fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
Si une grossesse survient durant l'utilisation de Herceptin / PERJETA/ Kadcyla /Phesgo ou dans les 7 mois qui suivent la dernière dose de Herceptin/Kadcyla/Phesgo ou dans les 6 mois qui suivent la dernière dose de PERJETA, veuillez immédiatement signaler la grossesse à la Drug Safety Line de Roche au +32 2 525 82 99.
Des informations supplémentaires seront demandées pendant la grossesse exposée au Herceptin / PERJETA / Kadcyla/ Phesgo et durant la première année de vie du nourisson. Cela permettra à Roche de mieux connaître la sécurité du Herceptin / PERJETA/ Kadcyla / Phesgo et de fournir des informations appropriées aux autorités sanitaires, aux prestataires de soins de santé et aux patients.
Nom du produit
Détails supplémentaires sur le produit
Qu'est-il arrivé au produit ?
Coordonnées
Veuillez fournir des informations sur les produits concernés. Vous pouvez ajouter plusieurs produits en utilisant le bouton "Ajouter un produit" au bas de cette page.
Je consens à ce que mes données soient traitées dans le but de répondre à ma demande et conformément à la Politique de Confidentialité de Roche & Notice de Confidentialité pour la Pharmacovigilance.
Vous consentez, en cochant la case ci-dessus, à ce que vos données soient traitées dans le but de répondre à votre demande et conformément à l'avis de Roche sur la confidentialité en matière de pharmacovigilance, d'informations médicales et de plaintes concernant les produits. Si vous ne consentez pas au traitement de vos données, nous ne pourrons pas répondre à votre message et vous prions de bien vouloir utiliser d'autres canaux pour nous contacter.
F. Hoffmann-La Roche Ltd ("Roche") conservera un enregistrement des données personnelles que vous fournissez dans le but de répondre à votre demande, de donner suite à de telles demandes, de conserver les informations dans la base de données d'informations médicales de Roche pour référence et de se conformer à nos obligations légales et réglementaires d'enregistrement et de rapport. La durée de conservation des données est conforme aux lois et règlements respectifs.
En incluant les données personnelles d'une autre personne dans le formulaire, vous déclarez la légalité du traitement de ces données personnelles.
La politique de confidentialité de Roche fournit des informations détaillées sur vos droits et sur la manière dont Roche traite les données personnelles.